2024年1月31日药学院游慧娟教授与童擎一副教授合作在化学领域顶级期刊《美国化学会志》Journal of the American Chemical Society上在线发表了题为Distinguishing G-Quadruplexes Stabilizer and Chaperone for c-MYC Promoter G-Quadruplexes through Single-Molecule Manipulation.的研究进展,报道了靶向G-四链体核酸的小分子药物抗肿瘤作用机制。
除了经典的B型双螺旋DNA结构以外,富含鸟嘌呤的DNA也能形成特殊的四链核酸结构G-四链体(G-quadruplexes,G4)。70%的癌基因启动子区域都有G4形成序列的存在,参与癌基因的表达调控。c-MYC是一种原癌基因,也是一种转录因子,影响许多基因的表达,让细胞异常增殖。然而,由于c-MYC蛋白没有明确的配体结合位点,使其成为了著名的“不可成药”靶点。2002年Hurley团队的开创性工作表明,结合G4的小分子TMPyP4能够稳定c-MYCG4,从而抑制c-MYC癌基因的表达。迄今为止,G4配体数据库G4LDB 2.2 (http://www.g4ldb.com)已收录超过4400个化合物。此前研究表明G4配体虽然也能和双链DNA结合,但是却能特异性的稳定G4(提高熔融温度Tm)。因此,本领域一个关键的问题G4配体是如何特异性的稳定G4。c-MYC启动子G4是最受关注的G4结构之一,由于其高稳定性和不同折叠构象的存在,难以用系综平均(ensemble average)的方法定量化合物对溶液中不同G4折叠构象。因此,精准测量小分子如何影响G-四链体折叠的热力学和动力学仍然是一个挑战。
华中科技大学同济医学院药学院游慧娟和童擎一团队合作首次在单分子水平揭示了G4配体特异性稳定c-MYC启动子G4的两种不同作用方式:通过降低G4的折叠速率的G4稳定剂和通过加速G4折叠速率的分子伴侣。由于小分子配体与双链handle之间的相互作用会增加单分子实验中检测G4去折叠信号的难度,在本研究中通过构建c-MYC启动子G4的双链发卡的单分子力学拉伸实验提高了信噪比,首次得以测量到加入化合物后c-MYCG4去折叠力的具体数值。该团队分析了6种经典的G4配体,其中CX5461表现出最强的降低c-MYCG4去折叠速率的能力,而双喹啉类化合物PDS和360A能够显著加速G4的折叠,促进G4结构的形成。在Raji细胞系和对照CA46细胞系的RT-PCR结果表明,CX-5461能够通过稳定G4显著下调c-MYC基因的表达。这些结果揭示了通过小分子配体调控G4的折叠/去折叠动力学,以精确调节癌基因表达的潜力。
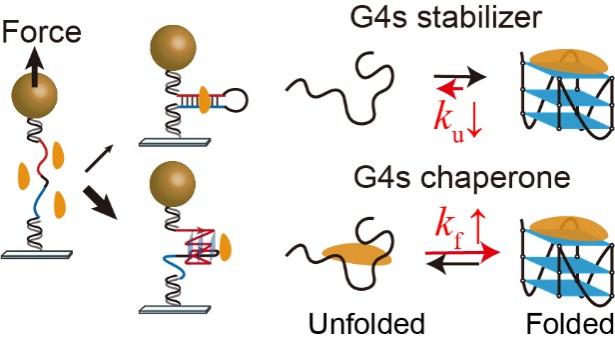
图1.单分子磁镊拉伸实验研究小分子调控G-四链体和双链的竞争。小分子稳定G-四链体的两种不同动力学机制:G4稳定剂和G4分子伴侣。
由于G-四链体形成序列在多个癌基因如KRAS,c-Kit, Bcl-2, VEGF的启动子区域均存在,通过小分子特异性稳定这些启动子G-四链体,为我们提供靶向多种“不可成药”癌基因的新策略。单分子的方法也为研究小分子如何调控核酸折叠动力学的基本原理提供了有力的工具,为靶向核酸的药物开发带来新突破。目前,G-四链体稳定剂CX-5461已进入II期临床实验。相信随着科技的进步,不久的将来,G-四链体及其配体的研究将取得更多进展,为人类健康事业做出贡献。
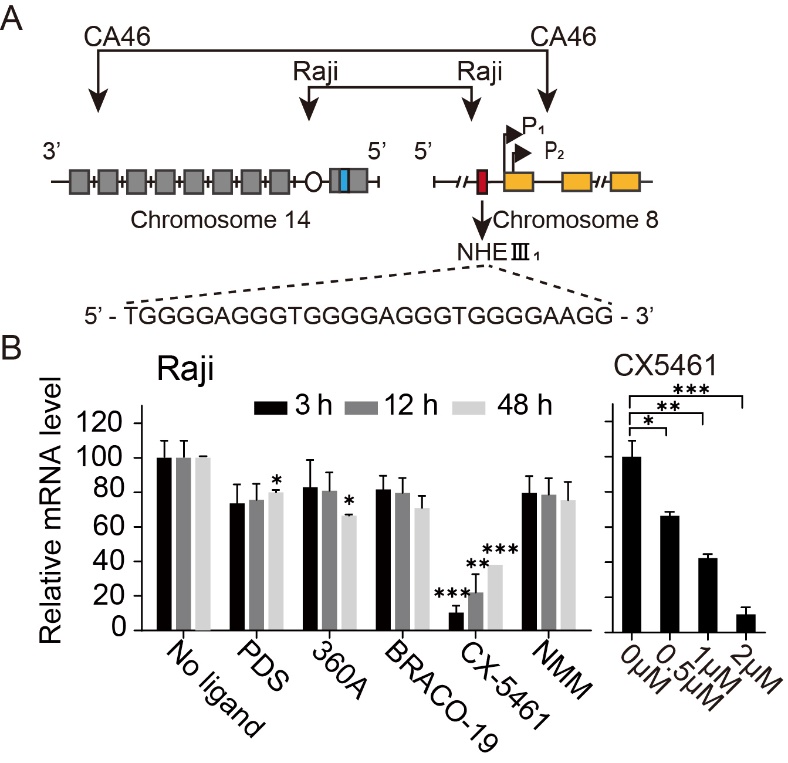
图2:RT-PCR结果表明CX-5461能通过稳定G-四链体抑制c-MYC癌基因的表达。其中Raji细胞的c-MYC启动子含有G4形成序列,而CA46细胞不含G4形成序列。
华中科技大学药学院博士生张雅硕和武汉市中心医院药学部程远磊博士为共同一作,游慧娟教授和童擎一副教授为共同通讯作者,吴曈勃教授参与研究。
论文信息:
https://pubs.acs.org/doi/10.1021/jacs.3c09074
Distinguishing G-Quadruplexes Stabilizer and Chaperone for c-MYC Promoter G-Quadruplexes through Single-Molecule Manipulation.
Zhang Y, Cheng Y, Luo Q, Wu T, Huo J, Yin M, Peng H, Xiao Y, Tong Q, You H.
J Am Chem Soc.2024, 146, 6, 3689–3699
